Алканы - соединения гомологического ряда метана. Это насыщенные нециклические углеводороды. Химические свойства алканов зависят от строения молекулы и физического состояния веществ.
Строение алканов
Молекула алкана состоит из атомов углерода и водорода, которые образуют метиленовые (-CH 2 -) и метильные (-CH 3) группы. Углерод может создавать четыре ковалентные неполярные связи с соседними атомами. Именно наличие прочных σ-связей -С-С- и -С-Н обуславливает инертность гомологического ряда алканов.

Рис. 1. Строение молекулы алкана.
Соединения реагируют на свету или при нагревании. Реакции протекают по цепному (свободно-радикальному) механизму. Таким образом, связи способны расщепляться только под действием свободных радикалов. В результате замещения водорода образуются галогеналканы, соли, циклоалканы.
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Химические свойства
Общие свойства алканов приведены в таблице.
|
Типы химических реакций |
Описание |
Уравнение |
|
Галогенирование |
Реагируют с F 2 , Cl 2 , Br 2 . Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы |
CH 4 + Cl 2 → CH 3 Cl + HCl |
|
Нитрование (реакция Коновалова) |
Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO 2 . В результате образуются нитроалканы |
CH 3 -CH 3 +HNO 3 → CH 3 -CH 2 -NO 2 + H 2 O |
|
Сульфохлорирование |
Сопровождается окислением с образованием алкансульфонилхлоридов |
R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl |
|
Сульфоокисление |
Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO 3 H |
C 5 H 10 + HOSO 3 H → C 5 H 11 SO 3 H + H 2 O |
|
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены |
C 4 H 10 → C 2 H 6 + C 2 H 4 |
|
|
В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи |
CH 4 + 2O 2 → CO 2 + 2H 2 O; 2CH 4 + 3O 2 → 2CO + 4H 2 O |
|
|
Каталитическое окисление |
Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты |
C 4 H 10 → 2CH 3 COOH + H 2 O |
|
Дегидрирование |
Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены |
C 2 H 6 → C 2 H 4 + H 2 |
|
Ароматизация |
Реакция дегидрирования с образованием циклоалканов |
C 6 H 14 → C 6 H 6 + 4H 2 |
|
Изомеризация |
Образование изомеров под действием температуры и катализаторов |
C 5 H 12 → CH 3 -CH(CH 3)-CH 2 -CH 3 |
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.

Рис. 2. Структурные формулы.
Применение
Алканы широко применяются в промышленной химии, косметологии, строительстве. Из соединений изготавливают:
- топливо (бензин, керосин);
- асфальт;
- смазочные масла;
- вазелин;
- парафин;
- мыло;
- лаки;
- краски;
- эмали;
- спирты;
- синтетические ткани;
- каучук;
- адьдегиды;
- пластмассы;
- моющие средства;
- кислоты;
- пропелленты;
- косметические средства.

Рис. 3. Продукция, получаемая из алканов.
Что мы узнали?
Узнали о химических свойствах и применении алканов. Из-за прочных ковалентных связей между атомами углерода, а также между атомами углерода и водорода, алканы проявляют инертность. Возможны реакции замещения и разложения в присутствии катализатора при высоких температурах. Алканы - предельные углеводороды, поэтому реакции присоединения невозможны. Алканы используются для производства материалов, моющих средств, органических соединений.
Тест по теме
Оценка доклада
Средняя оценка: 4 . Всего получено оценок: 71.
Каждый класс химических соединений способен проявлять свойства, обусловленные их электронным строением. Для алканов характерны реакции замещения, отщепления или окисления молекул. Все имеют свои особенности протекания, о которых пойдет дальше речь.
Что такое алканы
Это насыщенные углеводородные соединения, которые носят название парафинов. Их молекулы состоят только из атомов углеродных и водородных, имеют линейную или разветвленную ациклическую цепочку, в которой есть лишь одинарные соединения. Учитывая характеристику класса, можно вычислить, какие реакции характерны для алканов. Они подчиняются формуле для всего класса: H 2n+2 C n .
Строение химическое
Молекула парафинов включает углеродные атомы, проявляющие sp 3 -гибридизацию. У них все валентные четыре орбитали обладают одинаковой формой, энергией и направлением в пространстве. Размер угла между энергетическими уровнями составляет 109° и 28".
Наличие одинарных связей в молекулах определяет, какие реакции характерны для алканов. В них присутствуют σ-соединения. Связь между углеродами является неполярной и слабо поляризуемой, она немного длиннее, чем в C−H. Также наблюдается смещение электронной плотности к углеродному атому, как наиболее электроотрицательному. В результате соединение C−H характеризуется малой полярностью.
Реакции замещения
Вещества класса парафинов обладают слабой химической активностью. Это можно объяснить прочностью связей между C−C и C−H, которые трудно разорвать из-за неполярности. В основе их разрушения лежит механизм гомолитический, при котором участвуют радикалы свободного типа. Именно поэтому для алканов характерны реакции замещения. Такие веществ не способны взаимодействовать с молекулами воды или несущими заряд ионами.
Им причисляют замещение свободнорадикальное, в котором водородные атомы заменяются на галогеновые элементы или другие активные группы. К таким реакциям относят процессы, связанные с галогенированием, сульфохлорированием и нитрованием. Их результатом является получение алкановых производных.

В основе механизма реакций замещения по свободнорадикальному типу лежат основные три стадии:
- Начинается процесс с инициирования или зарождения цепочки, в результате которого формируются свободные радикалы. Катализаторами служат источники света ультрафиолетового и нагревание.
- Затем развивается цепочка, в которой осуществляются последовательные взаимодействия активных частиц с неактивными молекулами. Происходит их превращение в молекулы и радикалы соответственно.
- Конечным этапом будет обрыв цепочки. Наблюдается рекомбинация или исчезновение активных частиц. Так прекращается развитие цепной реакции.
Процесс галогенирования
В его основе лежит механизм радикального типа. Реакция галогенирования алканов проходит при облучении ультрафиолетом и нагревании смеси из галогенов и углеводородов.
Все стадии процесса подчиняются правилу, которое высказал Марковников. В нем указано, что подвергается замещению галогеном, прежде всего, который принадлежит самому гидрированному углероду. Галогенирование протекает в такой последовательности: от третичного атома до первичного углерода.
Процесс проходит лучше у молекул алканов с длинной основной углеродной цепочкой. Это связано с уменьшением ионизирующей энергии в данном направлении, от вещества легче отщепляется электрон.
Примером может служить хлорирование молекулы метана. Действие ультрафиолета приводит к расщеплению хлора на радикальные частицы, которые осуществляют атаку на алкан. Происходит отрыв атомарного водорода и формирование H 3 C· или метильного радикала. Такая частица, в свою очередь, атакует молекулярный хлор, приводя к разрушению ее структуры и образованию нового химического реагента.
На каждом этапе процесса осуществляется замещение только одного водородного атома. Реакция галогенирования алканов приводит к постепенному формированию хлорметановой, дихлорметановой, трихлорметановой и тетрахлорметановой молекулы.
Схематически процесс выглядит следующим образом:
H 4 C + Cl:Cl → H 3 CCl + HCl,
H 3 CCl + Cl:Cl → H 2 CCl 2 + HCl,
H 2 CCl 2 + Cl:Cl → HCCl 3 + HCl,
HCCl 3 + Cl:Cl → CCl 4 + HCl.
В отличие от хлорирования молекулы метана, проведение такого процесса с другими алканами характеризуется получением веществ, у которых замещение водорода происходит не у одного атома углерода, а у нескольких. Их количественное соотношение связано с температурными показателями. В холодных условиях наблюдается уменьшение скорости образования производных с третичной, вторичной и первичной структурой.
С повышением температурного показателя быстрота формирования таких соединений выравнивается. На процесс галогенирования существует влияние фактора статического, который указывает на разную вероятность столкновения радикала с углеродным атомом.

Процесс галогенирования йодом в обычных условиях не протекает. Необходимо создание специальных условий. При воздействии на метан данным галогеном происходит возникновение йодистого водорода. На него оказывает действие йодистый метил, в результате выделяются первоначальные реагенты: метан и йод. Такая реакция считается обратимой.
Реакция Вюрца для алканов
Является методом получения с симметричной структурой. В качестве реагирующих веществ используют натрий металлический, алкилбромиды или алкилхлориды. При их взаимодействии получают галогенид натрия и увеличенную углеводородную цепь, которая является суммой двух радикалов углеводородов. Схематически синтез выглядит следующим образом: R−Cl + Cl−R + 2Na → R−R + 2NaCl.
Реакция Вюрца для алканов возможна только в том случае, если в их молекулах галогены находятся у первичного углеродного атома. Например, CH 3 −CH 2 −CH 2 Br.
Если в процессе участвует галогенуглеводорододная смесь из двух соединений, то при конденсации их цепочек образуются три разных продукта. Примером такой реакции алканов может служить взаимодействие натрия с хлорметаном и хлорэтаном. На выходе получается смесь, содержащая бутан, пропан и этан.
Кроме натрия, можно применять другие щелочные металлы, к которым относят литий или калий.
Процесс сульфохлорирования
Его еще называют реакцией Рида. Протекает она по принципу свободнорадикального замещения. тип реакции алканов на действие смеси из диоксида серы и молекулярного хлора в присутствии ультрафиолетового излучения.
Процесс начинается с инициации цепного механизма, при котором из хлора получаются два радикала. Один из них атакует алкан, что приводит к возникновению алкильной частицы и молекулы хлороводорода. К углеводородному радикалу прикрепляется серы диоксид с формированием сложной частицы. Для стабилизации происходит захват одного хлорного атома из другой молекулы. Конечным веществом является сульфонилхлорид алкана, его применяют при синтезе поверхностно-активных соединений.
Схематически процесс выглядит так:
ClCl → hv ∙Cl + ∙Cl,
HR + ∙Cl → R∙ + HCl,
R∙ + OSO → ∙RSO 2 ,
∙RSO 2 + ClCl → RSO 2 Cl + ∙Cl.
Процессы, связанные с нитрованием
Алканы вступают в реакции с кислотой азотной в виде раствора 10%, а также с азота четырехвалентного оксидом в газообразном состоянии. Условиями ее протекания являются высокие температурные значения (около 140 °C) и низкие показатели давления. На выходе продуцируются нитроалканы.

Данный процесс свободнорадикального типа назвали в честь ученого Коновалова, открывшего синтез нитрования: CH 4 + HNO 3 → CH 3 NO 2 + H 2 O.
Механизм отщепления
Для алканов характерны реакции дегидрирования и крекинга. Молекула метана подвергается полному термическому разложению.
Основным механизмом вышеуказанных реакций является отщепление атомов от алканов.
Процесс дегидрирования
При отделении атомов водорода от углеродного скелета парафинов, за исключением метана, получаются непредельные соединения. Такие химические реакции алканов проходят в условиях высокой температуры (от 400 до 600 °C) и под действием ускорителей в виде платины, никеля, и алюминия.
Если в реакции участвуют молекулы пропана или этана, то ее продуктами будет пропен или этен с одной двойной связью.
При дегидрировании четырех или пятиуглеродного скелета получаются диеновые соединения. Из бутана формируются бутадиен-1,3 и бутадиен-1,2.
Если в реакции присутствуют вещества с 6 и более атомами углеродов, то образуется бензол. В нем имеется ароматическое ядро с тремя связями двойными.
Процесс, связанный с разложением
В условиях высокой температуры реакции алканов могут проходить с разрывом связей углеродных и формированием активных частиц радикального типа. Такие процессы называют крекингом или пиролизом.
Нагревание реагирующих веществ до температур, превышающих 500 °C, приводит к разложению их молекул, в ходе которого образуются сложные смеси из радикалов алкильного типа.

Проведение при сильном нагревании пиролиза алканов с длинными углеродными цепочками связано с получением предельных и непредельных соединений. Его называют термическим крекингом. Такой процесс использовали до середины 20 века.
Недостатком было получение углеводородов с низким октановым числом (не более 65), поэтому его заменили Процесс проходит при температурных условиях, которые ниже 440 °C, и значениях давления, меньше 15 атмосфер, в присутствие алюмосиликатного ускорителя с выделением алканов, имеющих разветвлённую структуру. Примером может служить метановый пиролиз: 2CH 4 → t ° C 2 H 2 + 3H 2 . В ходе данной реакции образуется ацетилен и молекулярный водород.
Молекула метана может подвергаться конверсии. Для такой реакции необходима вода и никелевый катализатор. На выходе получается смесь из угарного газа и водорода.
Окислительные процессы
Химические реакции, характерные для алканов, связаны с отдачей электронов.
Существует автоокисление парафинов. В нем задействован свободно-радикальный механизм окисления насыщенных углеводородов. В ходе реакции из жидкой фазы алканов получают гидроперекиси. На начальном этапе молекула парафина взаимодействует с кислородом, в результате выделяются активные радикалы. Далее с алкильной частицей взаимодействует еще одна молекула O 2 , получается ∙ROO. С перекисным радикалом жирной кислоты контактирует молекула алкана, после чего выделяется гидроперекись. Примером может служить автоокисление этана:
C 2 H 6 + O 2 → ∙C 2 H 5 + HOO∙,
∙C 2 H 5 + O 2 → ∙OOC 2 H 5 ,
∙OOC 2 H 5 + C 2 H 6 → HOOC 2 H 5 + ∙C 2 H 5 .
Для алканов характерны реакции горения, которые относятся к главным химическим свойствам, при определении их в составе топлива. Они имеют окислительный характер с выбросом тепла: 2C 2 H 6 + 7O 2 → 4CO 2 + 6H 2 O.
Если в процессе наблюдается малое количество кислорода, то конечным продуктом может быть уголь или углерода двухвалентный оксид, что определяется концентрацией O 2 .
При окислении алканов под влиянием каталитических веществ и нагревании до 200 °C получаются молекулы спирта, альдегида или карбоновой кислоты.
Пример с этаном:
C 2 H 6 + O 2 → C 2 H 5 OH (этанол),
C 2 H 6 + O 2 → CH 3 CHO + H 2 O (этаналь и вода),
2C 2 H 6 + 3O 2 → 2CH 3 COOH + 2H 2 O (этановая кислота и вода).

Алканы могут окисляться при действии на них трёхчленных циклических пероксидов. К ним относят диметилдиоксиран. Результатом окисления парафинов является молекула спирта.
Представители парафинов не реагируют на KMnO 4 или марганцовокислый калий, а также на
Изомеризация
На алканы тип реакции характеризуется замещением с электрофильным механизмом. Сюда причисляют изомеризацию углеродной цепи. Катализирует данный процесс алюминия хлорид, который взаимодействует с насыщенным парафином. Примером служит изомеризация молекулы бутана, которая становится 2-метилпропаном: C 4 H 10 → C 3 H 7 CH 3 .
Процесс ароматизации
Насыщенные вещества, у которых в основной цепочке углеродной содержится шесть или больше атомов углеродных, способны проводить дегидроциклизацию. Для коротких молекул не характерна такая реакция. Результатом всегда является шестичленный цикл в виде циклогексана и его производных.

В присутствии реакционных ускорителей проходит дальнейшее дегидрирование и превращение в более устойчивое бензольное кольцо. Происходит превращение ациклических углеводородов в ароматические соединения или арены. В качестве примера служит дегидроциклизация гексана:
H 3 C−CH 2 − CH 2 − CH 2 − CH 2 −CH 3 → C 6 H 12 (циклогексан),
C 6 H 12 → C 6 H 6 + 3H 2 (бензол).
Физические свойства алканов
В обычных условиях первые четыре члена гомологического ряда алканов (С 1 - С 4) - газы. Нормальные алканы от пентана до гептадекана (С 5 - С 17) - жидкости, начиная с С 18 и выше - твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов.
При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, т.к. их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких, как бензол, тетрахлорметан и т.п.
Строение
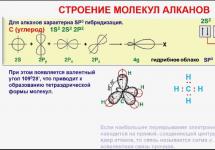
Молекула простейшего алкана - метана - имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах - атомы водорода. Углы между осями связей С-Н составляют 109°28" (рис. 29).
В молекулах других предельных углеводородов углы между связями (как С-Н, так и С-С) имеют такое же значение. Для описания формы молекул используется понятие гибридизации атомных орбиталей (см. часть I, §6).
В алканах все атомы углерода находятся в состоянии sp 3 - гибридизации (рис. 30).
Таким образом, атомы углерода в углеродной цепи не находятся на одной прямой. Расстояние между соседними атомами углерода (между ядрами атомов) строго фиксировано - это длина химической связи (0,154 нм). Расстояние С 1 - С 3 , С 2 - С 4 и т.д. (через один атом) тоже постоянны, т.к. постоянен угол между связями -валентный угол.

Расстояния между более удаленными атомами углерода могут изменяться (в некоторых пределах) в результате вращения вокруг s-связей. Такое вращение не нарушает перекрывания орбиталей, образующих s-связь, поскольку эта связь имеет осевую симметрию.


Разные пространственные формы одной молекулы, образующиеся при вращении групп атомов вокруг s-связей, называют конформациями (рис. 31).
Конформации различают по энергии, но это различие невелико (12-15 кДж/моль). Более устойчивы такие конформации алканов, в которых атомы расположены возможно дальше друг от друга (отталкивание электронных оболочек). Переход от одной конформации к другой осуществляется за счет энергии теплового движения. Для изображения конформации используют специальные пространственные формулы (формулы Ньюмена).
Не путать!
Следует различать понятия конформация и конфигурация.
Разные конформации могут превращаться друг в друга без разрыва химических связей. Для превращения молекулы с одной конфигурацией в молекулу с другой конфигурацией требуется разрыв химических связей.
Из четырех видов изомерии для алканов характерны два: изомерия углеродного скелета и оптическая изомерия (см. часть
Химические связи в алканах, их разрыв и образование определяют химические свойства алканов. Связи С-С и С-Н ковалентные, простые (s-связи), практически неполярные, достаточно прочные, поэтому:
1) алканы вступают чаще всего в такие реакции, которые идут с гемолитическим разрывом связей;
2) по сравнению с органическими соединениями других классов алканы обладают низкой реакционной способностью (их за это называют парафинами - «лишенными свойства»). Так, алканы устойчивы к действию водных растворов кислот, щелочей и окислителей (например, перманганата калия) даже при кипячении.
Алканы не вступают в реакции присоединения к ним других молекул, т.к. алканы не имеют в своих молекулах кратных связей.
Алканы подвергаются разложению при сильном нагревании в присутствии катализаторов в виде платины или никеля, при этом от алканов отщепляется водород.
Алканы могут вступать в реакции изомеризации. Характерной реакцией для них является реакция замещения, протекающая по радикальному механизму.
Химические свойства
Реакции радикального замещения
В качестве примера рассмотрим взаимодействие алканов с галогенами. Фтор реагирует очень энергично (как правило, со взрывом) - при этом рвутся все С-Н и С-С связи, и в результате образуются соединения CF 4 и HF. Практического значения реакция не имеет. Иод с алканами не взаимодействует. Реакции с хлором или бромом идут либо при освещении, либо при сильном нагревании; при этом происходит образование от моно- до полигалогензамещенных алканов, например:
СН 3 -СН 3 +Сl 2 ® hv СН 3 -СН 2 -Сl+НСl
Образование галогенопроизводных метана протекает по цепному свободнорадикальному механизму. Под действием света молекулы хлора распадаются на неорганические радикалы:
Неорганический радикал Сl . отрывает от молекулы метана атом водорода с одним электроном, образуя НС1 и свободный радикал СН 3
![]()
Свободный радикал взаимодействует с молекулой хлора Сl 2 , образуя галогенопроизводное и радикал хлора.
![]()
Реакция окисления начинается с отрыва атома водорода молекулой кислорода (которая представляет собой бирадикал) и далее идет как разветвленная цепная реакция. Количество радикалов в ходе реакции увеличивается. Процесс сопровождается
выделением большого количества теплоты, рвутся уже не только С-Н, но и С-С связи, так что в результате образуется оксид углерода (IV) и вода. Реакция может протекать как горение или приводит к взрыву.
2С n Н2 n+2 +(3n+1)О 2 ®2nСO 2 +(2n+2)Н 2 O
При обычной температуре реакция окисления не идет; ее можно инициировать либо поджиганием, либо действием электрического разряда.
При сильном нагревании (свыше 1000°С) алканы полностью разлагаются на углерод и водород. Эта реакция называется пиролизом.
СН 4 ® 1200° С+2Н 2
При мягком окислении алканов, в частности метана, кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота.

Если метан пропускать через нагретую зону очень быстро, а затем сразу охлаждать водой, то в результате образуется ацетилен.
Эта реакция - основа промышленного синтеза, который называется крекингом (неполным разложением) метана.
Крекинг гомологов метана проводят при более низкой температуре (около 600°С). Например, крекинг пропана включает следующие стадии:

Итак, крекинг алканов приводит к образованию смеси алканов и алкенов меньшей молекулярной массы.
Нагревание алканов до 300-350°С (крекинг еще не идет) в присутствии катализатора (Pt или Ni) приводит к дегидрированию - отщеплению водорода.

При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:
СН 3 -СН 3 + HNO 3 ®CH 3 -CH 2 -NO 2 + Н 2 О Изомеризация
При определенных условиях алканы нормального строения могут превращаться в алканы с разветвленной цепью.
Получение алканов
Рассмотрим получение алканов на примере получения метана. Метан широко распространен в природе. Он является главной составной частью многих горючих газов, как природных (90-98%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дна болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным газом или рудничным газом.
В лаборатории метан получают при нагревании смеси ацетата натрия с гидроксидом натрия:
CH 3 COONa+NaOH® 200° Na 2 CO 3 +CH 4
или при взаимодействии карбида алюминия с водой: Аl 4 Сl 3 +12H 2 O®4Аl(ОН) 3 +3CH 4
В последнем случае метан получается весьма чистым.
Метан может быть получен из простых веществ при нагревании в присутствии катализатора:
С+2Н 2 ® Ni СН 4 8 также синтезом на основе водяного газа
CO+3H 2 ® Ni CH 4 +H 2 O
Этот способ имеет промышленное значение. Однако используют обычно метан природных газов или газов, образующихся при коксовании каменных углей и при переработке нефти.
Гомологи метана, как и метан, в лабораторных условиях получают прокаливанием солей соответствующих органических кислот с щелочами. Другой способ - реакция Вюрца, т.е. нагревание моногалогенопроизводных с металлическим натрием, например:
С 2 Н 5 Br+2Na+BrC 2 H 6 ® С 2 Н 5 -С 2 Н 5 +2NaBr
В технике для получения технического бензина (смесь углеводородов, содержащих 6-10 атомов углерода) применяют синтез
из оксида углерода (II) и водорода в присутствии катализатора (соединения кобальта) и при повышенном давлении. Процесс
можно выразить уравнением
nСО+(2n+1)Н 2 ® 200° C n H 2n+2 +nН 2 O
I Итак, основным источником алканов служат природный газ и нефть. Однако некоторые предельные углеводороды синтезируют из других соединений.
Применение алканов
Большая часть алканов используется как топливо. Крекинг и
Дегидрирование их приводит к непредельным углеводородам, на
базе которых получают множество других органических веществ.
Метан - основная часть природных газов (60-99%). В состав
природных газов входят пропан и бутан. Жидкие углеводороды
применяются в качестве горючего в двигателях внутреннего сгорания а автомашинах, самолетах и др. Очищенная смесь жидких
и твердых алканов образует вазелин. Высшие алканы являются
исходными веществами при получении синтетических моющих средств. Алканы, полученные путем изомеризации, используются в производстве высококачественных бензинов и каучука. Ниже приведена схема применения метана

Циклоалканы
Строение
Циклоалканы - насыщенные углеводороды, в молекулах которых имеется замкнутое кольцо из углеродных атомов.
Циклоалканы (циклопарафины) образуют гомологический ряд с общей формулой С n Н 2 n , в котором первым членом является
циклопропан С 3 Н 6 , т.к. для образования кольца необходимо наличие не менее трех атомов углерода.
Циклоалканы имеют несколько названий: циклопарафины, нафтены, цикланы, полиметилены. Примеры некоторых соединений:

Формула С n Н 2 n характерна для циклопарафинов, и точно такая же формула описывает гомологический ряд алкенов (непредельных углеводородов, имеющих одну кратную связь). Из этого можно сделать вывод, что каждому циклоалкану изомерен соответствующий алкен - это пример «межклассовой» изомерии.
Циклоалканы по размеру цикла делятся на ряд групп, из которых рассмотрим две: малые (С 3 , С 4) и обычные (С 5 -С 7) циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле проводят так, чтобы заместители получили наименьшие номера.
Структурные формулы циклоалканов обычно записываются в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода. Например:

Структурная изомерия циклоалканов обусловлена размером цикла (циклобутан и метилциклопропан - изомеры) и положением заместителей в цикле (например, 1,1- и 1,2-диметилбутан), а также их строением.
Пространственная изомерия также характерна для циклоалканов, т.к. она связана с различным расположением заместителей относительно плоскости цикла. При расположении заместителей по одну сторону от плоскости цикла получаются цис-изомеры, по разные стороны - транс-изомеры.
Физические свойства . В обычных условиях первые четыре члена гомологического ряда алканов (С 1 - С 4) - газы. Нормальные алканы от пентана до гептадекана (C 5 - C 17 ) - жидкости, начиная с С 18 и выше - твердые вещества. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов . При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы .
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды, они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан и др. Жидкие алканы легко смешиваются друг с другом.
Основные природные источники алканов - нефть и природный газ. Различные фракции нефти содержат алканы от C 5 H 12 до С 30 Н 62 . Природный газ состоит из метана (95%) с примесью этана и пропана.
Из синтетических методов получения алканов можно выделить следующие:/>
1
. Получение из ненасыщенных углеводородов. Взаимодействие алкенов
или алкинов
с водородом ("гидрирование") происходит в присутствии металлических катализаторов (/>Ni
,
Pd
) при
нагревании:
СН з —C ≡СН + 2Н 2 → СН 3 -СН 2 -СН 3 .
2 . Получение из галогенпротводных . При нагревании моногалогензамещенных алканов с металлическим натрием получают алканы с удвоенным числом атомов углерода (реакция Вюрца ):/>
С 2 Н 5 Br + 2 Na + Br — C 2 H 5 → C 2 H 5 — C 2 H 5 + 2 NaBr .
Подобную реакцию не проводят с двумя разными галогензамещенными алканами , поскольку при этом получается смесь трех различных алканов
3 . Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот с щелочами получаются алканы , содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот:/>
4 .Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:/>
С + 2Н 2 → СН 4 .
Такая же реакция идет при нагревании углерода в атмосфере водорода до 400-500 °С при повышенном давлении в присутствии катализатора.
В лабораторных условиях метан часто получают из карбида алюминия:
А l 4 С 3 + 12Н 2 О = ЗСН 4 + 4А l (ОН) 3 .
Химические свойства . В обычных условиях алканы химически инертны . Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями — перманганатом калия KMn О 4 и т.п.
Химическая устойчивость алканов объясняется высокой прочностью s — связей С-С и С-Н, а также их неполярностью . Неполярные связи С-С и С-Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, обозначаемого символом S R (от англ , substitution radicalic ). По этому механизму легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
1. Галогенирование . При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов . Общая схема этой реакции показана на примере метана:/>
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl · + СН 4 →НС/>l + СН 3 ·
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН 3 · + С l 2 →СН 3 С l + С l ·
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl · + Cl · → С l/> 2 , СН 3 · + СН 3 · → С 2 Н 6 , СН 3 · + Cl · → СН 3 С l ·
Суммарное уравнение реакции:
| hv | ||
| СН 4 + Сl 2 | → | СН 3 Сl + НСl. |
Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов CH 2 Cl 2 , CHCl 3 , СС l 4 по схеме (*).
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.И. Семенова (1896-1986).
2. Нитрование (реакция Коновалова) . При действии разбавленной азотной кислоты на алканы при 140°С и небольшом давлении протекает радикальная реакция:/>
При радикальных реакциях (галогенирование, нитрование) в первую очередь замешаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода. Это объясняется тем, что легче всего разрывается гомолитически связь третичного атома углерода с водородом (энергия связи 376 кДж/моль), затем - вторичного (390 кДж/моль) и только потом - первичного (415 кДж/моль).
3. Изомеризация . Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:/>
4. Крекинг
- это гемолитический разрыв связей С-С
, который протекает при нагревании и под действием катализаторов.
При крекинге высших
алканов
образуются алкены
и низшие алканы
, при крекинге метана и этана образуются ацетилен:/>
C/> 8 H 18 → C 4 H 10 + С 4 Н 8 ,/>
2СН 4 → С 2 Н 2 + ЗН 2 ,
С 2 Н 6 → С 2 Н 2 + 2Н 2 .
Эти реакции имеют большое промышленное значение. Таким путем высококипящие фракции нефти (мазут) превращают в бензин, керосин и другие ценные продукты.
5. Окисление . При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
 |
Мягкое каталитическое окисление бутана кислородом воздуха — один из промышленных способов получения уксусной кислоты:
t
°
2
C 4/> H/> 10
+ 5
O/> 2
→ 4
CH/> 3
COOH/> + 2Н 2 О .
кат
На воздухе алканы сгорают до СО 2 и Н 2 О:/>
С n Н 2 n +2 + (З n +1)/2О 2 = n СО 2 + (n +1)Н 2 О.